(나는 곧 나의 커넥톰이다)
나(I)와 당신(You)은 다르다. 겉보기엔 굉장히 비슷해 보이는 일란성 쌍둥이조차도. 지구 위에 살고 있는 70억 명 중 단 한 사람도 똑같은 사람이 없다면, 과연 무엇이 나와 당신을 다르게 만드는 것일까?
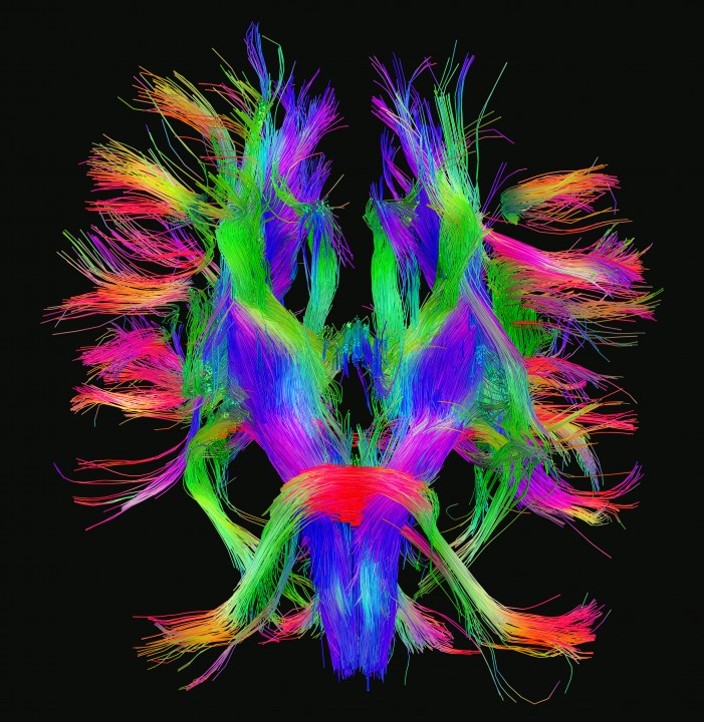
미국 프린스턴 대학의 세바스찬 승 교수는 TED 강연1)을 통해, 당신이 당신임을 만드는 것은 다름 아닌 '커넥톰(Connectome)'이라는 인상적인 주장을 펼쳤다. '뇌 속 신경세포인 뉴런들의 연결망'을 뜻하는 커넥톰은 지문처럼 사람마다 다른 형태로 나타난다. 즉, 단순히 유전정보만이 한 사람을 결정짓는 것이 아니라 주변환경, 그리고 새로운 경험을 통해서 얻은 고유한 커넥톰이 우리를 우리답게 만드는 것이다.
인간커넥톰프로젝트
(The Human Connectome Project)
지난 2010년 9월, 미국 국립보건원(NIH)은 4천만 달러를 인간커넥톰프로젝트(The Human Connectome Project, HCP)에 투자하며 본격적인 커넥톰 연구의 문을 열었다.
새로운 곳을 여행할 때 어떻게 계획을 세우는가? 올겨울, 아이슬란드에 있는 최대의 온천지인 블루라군(Blue Lagoon)을 방문하기 위해 여행 계획을 세운다고 가정해보자. 일단, 구글 맵을 실행해 아이슬란드와 한국 사이의 거리를 확인하고, 수도인 Reykjavik 주위로 화면을 이동해 주변 지역을 확대해야 한다. 다음에는 Keflavik 국제공항에서 블루라군까지 이동하는 교통 편을 확인하고, 언제부터 입욕할 수 있는지 살펴볼 것이다. 이와 유사하게 HCP 프로젝트의 궁극적인 목표도 뇌 속의 각 하부 영역들과 각 영역을 구성하는 신경세포들 사이의 연결을 속속들이 알 수 있는 지도를 작성하는 데 있다.
인간의 뇌에는 약 1,000억 개의 신경세포가 있다. 각 뉴런은 다시 1 만개와 연결되며, 그 연결은 노화, 질병, 학습에 의해 시시각각 변화한다. HCP 프로젝트는 300쌍의 쌍둥이와 그들의 형제들로 구성된 1,200명의 건강한 성인을 대상으로 그들의 구조적ᆞ기능적 신경망 지도를 완성하고자 한다.
구글 맵을 작성하기 위해 GPS 기술이 필요했다면, HCP 프로젝트를 완성하기 위해서는 해상능이 뛰어난 현미경 이미징 기술과 이를 통해 얻은 방대한 데이터를 처리할 분석 기술이 필요하다. 이를 위해 연구진들은 기존 임상용 자기공명영상(Magnetic Resonance Imaging, MRI)보다 약 2.5-10배 더 해상능이 좋은 장치를 개발함과 더불어 뇌를 복셀(Voxel, 부피를 가지는 픽셀) 단위로 쪼개서 HARDI(High Angular Resolution Diffusion Imaging)라는 이미지 분석기술을 이용해 뇌의 회백질에서 백질로 향하는 신경 다발의 물리적 연결을 살펴보고 있다.
MRI 기술을 통해 살아있는 뇌의 거시적 연결을 살펴보고 있다면, 전자현미경(Electron Microscopy)을 이용해 중간 및 미시적 규모의 커넥톰 연구도 이뤄지고 있다.
이상하게 들리겠지만 불과 1년전만 해도 그 어떤 포유류의 신경망 지도도 완성된 적이 없었다. 비교적 단순한 예쁜꼬마선충의 신경세포 302개가 만들어낸 7000개 이상의 연결망을 모두 그리는 데만 20년이나 소요되었다. 2014년 10월, 드디어 미국의 Allen Institute 연구소가 중간 규모 쥐의 커넥톰을 발표하였다. 이들은 EGFP(녹색 형광단백질)를 발현시킬 수 있는 아데노바이러스를 특정 뇌 영역(예, 대뇌피질, 시상, 소뇌 등)들에 주입해 관심 있는 신경세포들을 표지하였다. 이후, 0.35-um 두께로 각 뇌를 절편화하고 이를 연속 이광자 현미경(Serial Two-photon microscopy)으로 촬영해 뇌의 하부 영역들 간의 연결망을 체계적으로 그려냈다.
반면, 개별 신경세포 수준의 연결을 살피기 위해 하버드 대학교 연구진들은 망막 절세포(Retinal Ganglion Cell)들의 연결을 관찰하기 위헤 400 X 400 X 250 um 크기의 시상(Thalamus) 조직블록을 9000 개의 절편으로 나눈 후, 각 절편을 각각 주사 전자현미경(Scanning Electron Microscope)으로 촬영하였다. 개별 신경세포의 분지 정도까지 확인 가능한 4-nm의 고해상도로 전체 이미지를 얻는데 꼬박 100여 일이 걸렸으나, 뇌 조직의 극히 일부(1mm3)를 촬영하는 데만 수년이 소요될 것으로 추정되므로, 현재의 기술로 인간의 전체 뇌를 나노미터 수준의 해상능으로 전부 촬영하기에는 아직 현실적인 어려움이 있다.
신경망 연결장애(Connectopathy)
갑자기 인천 국제공항이 일시적으로 폐쇄된다면 어떤 일이 벌어질까. 항공기들이 오도 가도 못하는 혼돈이 벌어질 것이다. 뇌에서도 비슷한 상황이 벌어진다면? 정상인의 신경망 지도가 완성되면 그다음은 각종 신경질환을 앓고 있는 환자들의 커넥톰을 정상인의 그것과 비교해볼 차례다.
대부분의 신경질환은 뇌의 국소 부위에 병변이 생겨 해당 부위에 기능적인 손상이 발생하거나 주위 영역들 간의 연결에 문제가 생긴 경우에 발생한다. 넓게 보면, 이들 모두 ‘신경세포 사이의 연결에 문제’가 있는 신경망 연결장애(Connectopathy)로 간질이나 자폐증 같은 신경발달질환이나 조현병(Schizophrenia) 등의 정신질환, 그리고 알츠하이머 및 파킨슨병으로 대표되는 신경퇴행성질환까지 모두 신경망 연결장애로 볼 수 있다.
소아 자폐증 환자의 뇌를 MRI로 촬영해보면 뇌의 백질 일부는 더디게 발달하는 반면, 사회적 상호작용에 중요한 영역인 피곡(Putamen)과 전대상피질(Anterior Cingulate Cortex)은 과성장을 보인다. 확산 텐서 이미징(Diffusion Tensor Imaging, DTI)을 이용해 조현병 환자 뇌의 구조적, 기능적 연결을 살펴보면, 정상인보다 전두엽ᆞ측두엽ᆞ시상ᆞ선조체를 둘러싼 신경망의 기능과 구조적 안정성이 저하된 것으로 보인다. 치매의 대표적인 원인으로 알려진 알츠하이머 환자들에게서는 아밀로이드-베타라는 단백질 응집체가 뇌의 주요 영역에 축적되어있다. 피츠버그 대학 연구진들은 PiB(Pittsburgh Compound B)라는 방사능 물질로 이 응집체들을 추적해 양성자 방출 단층 촬영법(Positron Emission Tomography)으로 촬영하였는데, 결과적으로, 응집체들이 축적된 장소에서 정상의 경우보다 신경세포 간 연결이 상대적으로 망가져 있다는 사실을 밝혔다.
커넥톰 연구는 각종 질환에서 어떤 물리적인 연결이 망가졌는지를 가시화함과 동시에 질병의 원인 분석에도 도움을 줄 수 있다. 최근 필자가 속한 KAIST 의과학대학원 이정호 교수 연구팀은 소아에서 난치성 간질을 보이는 국소 피질 이형성(Focal Cortical Dysplasia, FCD)이 대뇌 피질 일부에만 존재하는 mTOR 유전자의 체성 유전변이(somatic mutation) 때문에 발생한다는 사실을 규명했다. 이는 뇌전도(Electroencephalography)를 이용해 과활성화된 대뇌 피질 일부를 채취 후, 유전분석을 통해 얻어낸 결과이다. 현재 몇몇 그룹들이 이처럼 자폐증 혹은 조현병 환자의 기능이 과활성/저하된 커넥톰 혹은 알츠하이머 환자들에서 병변이 시작/과축적된 곳에 존재하는 특이적 유전변이들이 해당 질환을 초래하지 않았겠냐는 가설하에 실험을 진행 중이다.
커넥톰 연구의 미래는 어떤 모습일까?
2003년, 인간게놈프로젝트(Human Genome Project)를 통해 인간 유전체지도가 완성된 이후 유전정보는 각종 질병의 진단 및 치료에 여러모로 이용되고 있다. 마찬가지로, 인간커넥톰프로젝트를 통해 신경망 지도를 완성하게 되면 유전적 요인만으로 설명되기 어려웠던 많은 신경망 연결장애의 진단과 치료에도 큰 실마리를 제공할 것이다.
가까운 미래에는 개개인의 커넥톰 분석으로 신경망 이상을 살피고, 시뮬레이션을 통해 특정 신경질환에 취약한지 미리 진단하여 환자별 맞춤 치료를 기대할 수 있을 것이다. 앞서 언급했다시피 아직은 초고해상도로 신경세포들의 각 연결을 완벽히 파악하는 데는 한계가 있으며, 방대한 데이터를 처리하는 속도도 더디다. 하지만 유전체 지도의 작성 후, 차세대 염기서열분석(Next Generation Sequencing)이나 CRISPR 등의 유전자 표적 가위 기술이 발달해 각종 유전병의 이해와 치료에 이바지한 것처럼 커넥톰 연구가 미래 신경생물학 연구 발전의 밑거름이 되는 동시에 신경망 장애 환자들의 질병 부담을 낮추는 데도 크게 기여할 것이라 기대해본다.
1) http://www.ted.com/talks/sebastian_seung?language=ko
저작권자 © 포항공대신문 무단전재 및 재배포 금지


